癌细胞转移的秘密通道
[文章选自]《科学最前沿 医药篇:现代医学真的进步了吗》 --撰文/克里斯廷•索亚雷斯(Christine Soares)
内容简介:癌细胞的扩散似乎更偏爱某些器官,如肺部和肝脏。研究表明,癌细胞会被受伤或发炎的组织所吸引,到新的部位安家落户。如果我们能够阻断这些适于癌细胞生长的环境发出的信号,就能减少肿瘤转移。
伦敦外科医生约翰•佩吉特(John Paget)一直致力于探索肿瘤转移。1889年,他在《柳叶刀》杂志中发出这样的疑问:“到底是什么因素决定了何种器官将蒙受癌细胞扩散之苦呢?”他推测,癌细胞扩散至身体各个部位的机会是均等的,但转移集落(metastatic colony,即癌细胞扩散到其他组织上建立的“根据地”)似乎更偏爱某些特定器官,如肺部和肝脏。佩吉特设想,恶性细胞的转移或许如同植物种子那样,可以随风飘至各处,但“只有落在适宜的土壤中,才能生根发芽”。
直到今天,科学家们仍在孜孜以求,试图理解到底是“种子”的特质,还是“土壤”的属性,决定了扩散中的肿瘤将在何处落地生根。越来越多的证据表明二者都发挥了重要作用。最近,日本的研究人员为该理论补充了一些有趣的细节。在这项研究中,他们揭示了远处的癌细胞与肺中未来的转移点位发生相互作用的过程,它们是如何通过一个与病原体免疫应答有关的信号传输机制相互沟通的。按照东京女子医科大学的资深研究人员丸义朗(Yoshiro Maru)的说法,这条信号通路牵涉其中也许还能提供一条线索,帮助解释为什么一些特定的器官,看起来更容易受到癌症转移的影响。丸义朗解释说:“肺部对微生物很敏感;它是我们人体的第一道防线。因此任何刺激,例如癌细胞的出现,都可能被负责宿主防御机制的器官识别。这就是我们的猜想。”
丸义朗和他的同事将黑色素瘤或肺癌细胞注射入健康小鼠的背部,结果发现,在这些恶性细胞转移到小鼠肺部之前很久,癌细胞分泌的炎性物质(inflammatory chemical)就在肺部引发了一种应答。这种应答由名叫巨噬细胞(macrophage)的局部免疫细胞和肺部的内皮细胞发起,会导致S100蛋白家族中一些成员的产生(特别是S100A8和S100A9)。按照丸义朗的说法,这些蛋白会向更多巨噬细胞发出信号,让它们蜂拥而至;而后这些细胞又开始释放S100 蛋白。最终,癌细胞会在肺部被S100蛋白“标记”的位点上落地生根,形成集落。
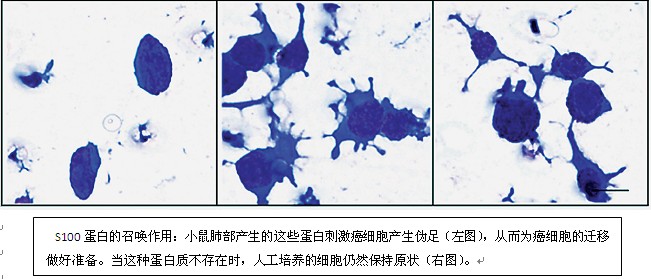
丸义朗的研究小组发现,除了会在肺部的这些位点上标上记号以外,S100蛋白(或者它们引发的一些次级化学信号)似乎还会召唤恶性细胞。将人工培养的癌细胞暴露在含有S100蛋白的肺血清中,甚至能够激发癌细胞形成侵袭伪足(invadopodia,帮助癌细胞侵袭组织的一种特殊的足突状细胞结构),为癌细胞的转移做好准备。在活体小鼠体内中和S100 蛋白,能够极大地减少癌细胞注射形成的转移灶的数量。
肺中产生的S100蛋白能够吸引远处的巨噬细胞和癌细胞,这一现象表明,正常的免疫应答可能在不经意间激发了肿瘤的转移。丸义朗指出:“把癌细胞注射到小鼠背部时,别处的巨噬细胞也会迁移到肺部。出现这种情况的原因,我们还无法理解。”、
若干研究已经表明,癌细胞会被受伤或发炎的组织所吸引,也许正是损伤部位向组织修复系统发出的求助信号,引导癌细胞抵达受伤部位。例如,美国纽约市韦尔•康奈尔医学院(Weill Cornell Medical College)的戴维•莱登(David Lyden)和沙欣•拉菲伊(Shahin Rafii)已经证明,来自于骨髓的血管祖细胞会在肺部或其他器官未来的肿瘤转移位点安家落户,如同先遣部队一样为癌细胞提前营造一个舒适的小环境。只有让那些祖细胞不受信号分子的影响,或者将它们从骨髓中全部移出,才能防止肿瘤的转移。
针对丸义朗研究小组的工作,莱登和拉菲伊在《自然•细胞生物学》杂志上发表了一篇评论。他们指出,总体上看,这些结果“建立了一个新的概念,那就是肿瘤转移的可能性也许不仅仅依赖于癌细胞的肿瘤扩散能力,还依赖于每个特定器官中能够接受转移细胞的‘热点’”。拉菲伊相信,如果我们能够识别更多不同器官的“热点”发出的精确信号,并将它们及时阻断,这些“土壤”对肿瘤来说可能就不再是“安乐窝”了。
(译/冯志华)
<b>延伸阅读:特定的信号传递</b>
研究人员已经发现,小鼠骨髓细胞能够迁移到预转移位点,但这些位点所在的位置则取决于注入小鼠体内的不同的癌细胞类型。如果注射的是肺癌细胞,骨髓细胞则主要迁移至肺部和肝脏;如果是黑色素瘤细胞,骨髓细胞则会扩散到多个器官,这与人体中这些癌症转移的经典路线如出一辙。
不论在哪种肿瘤的刺激下,S100蛋白都产生于肺部而非其他器官。结合这一发现,一些研究者认为,不同类型癌症激发的信号可能刺激不同组织产生特定应答。这些相互作用的信号也许可以解释,为什么大多数转移性癌症似乎更偏爱某些特定的器官。例如,结肠癌扩散时,转移至肝脏的可能性高达95%。






 京公网安备 11010802032529号
京公网安备 11010802032529号